الدور الوظيفي للاكتوفيرين دراسة أعدها الدكتور د. عصمت علي السيد علي الباحث بقسم بحوث تكنولوجيا الألبان، أوضح فيها إن الميكروبات الممرضة تعتبر من العوامل الهامة التي تنبه حدوث الالتهابات المعوية و تشتمل العديد من البكتريا الممرضة ضمن تركيبها على مكون يسمى الليبوبولي سكاريد Lipopolysaccharides (LPS) والذي يعتبر أحد المكونات الهامة في الغشاء الخارجي للجدار الخلوي للبكتريا السالبه لجرام. يؤدي هذا المكون السام الى زيادة نفاذية الغشاء الخلوي للخلايا المعوية في القناة الهضمية مما يؤدي الى فقده لوظيفته و في النهاية تحدث عملية الاستجابة الالتهابية.
وعلى الرغم من ان الاستجابة الالتهابية تكون عملية ذاتية الاتزان self-balanced process وتساعد في استعادة وحفظ التوازن في اماكن الالتهاب الا ان بعض التغيرات الالتهابية المفرطة وغير المنضبطة تؤدي الى حدوث امراض مزمنة غالبا في اماكن العدوى. كما تتكون كمية كبيرة من بعض المواد المحفزة للالتهابات مثل , pro-inflammatory cytokines (IL-8, IL-1β), TNF-α وتفرز هذه المواد بواسطة الخلايا الطلائية المعوية و الخلايا المناعية المختلفة. كما يزداد الجهد التأكسدي oxidative stress نتيجة تكون كمية كبيرة من reactive oxygen species (ROS) .
ومن المعتقد ان هذا المركب الاخير يعمل كمنبه لحدوث الالتهابات عن طريق قدرته على تحفيز انتاج كمية كبيرة من IL-8 في الخلايا الطلائية ويؤدي الانتاج الكبير من هذه المكونات الى مضاعفة حدوث الالتهابات مما مؤديا الى حدوث اعراض اكلينيكية.
ونظرا للتأثيرات الجانبية غير المرغوبة للادوية المضادة للالتهابات والمضادة للاكسدة، فقد ازداد الاهتمام باستخدام المواد الغذائية التي تعمل على تعديل او تخفيف او منع حدوث عملية الالتهاب. نظرا لقدرة تلك المواد على العمل كمضاد للاكسدة والميكروبات والالتهابات بدرجة كبيرة فمن المفترض ان اللاكتوفيرين و الببتيدات المشتقة منه تلعب دورا هاما في منع تطور الالتهابات والحد منها. وقد دعمت هذه الفرضية باكتشاف قدرة اللاكتوفيرين على العمل كماده معادلة لفعل السموم الميكروبية. كما ان وجود اللاكتوفيرين بتركيز عالي في اماكن الالتهابات اكد هذه الفرضية.
شاهد أيضا: كيفية تحقيق القيمة المضافة وكيفية الوصول اليها فى المجال الزراعي
اللاكتوفيرين: التركيب و الوظيفة لمعرفة الدور الوظيفي للاكتوفيرين
من المعروف ان لبن الام غني بالعديد من المواد النشطة بيولوجيا والمفيدة في حفظ صحة الاطفال حديثي الولادة. ويعتبر اللاكتوفيرين احد هذه المكونات الفعالة. وقد عزل هذا البروتين لاول مره من لبن الابقار ثم من لبن الام كما انه يعتبر ثانى اكثر البروتينات تركيزا في لبن الام و ينتمي الى عائلة الترانسفيرين التى تتميز بقدرتها على ربط ونقل الحديد وتنظيم عملية امتصاصه. كما انه يعتبر البروتين الرئيس القادر على الارتباط بالحديد في اللبن. ويفرز بواسطة الخلايا الطلائية في معظم الثدييات ويعتبر خط الدفاع الاول للجسم ضد العدوى الميكروبية. ويتواجد بتركيز عالي في سرسوب لبن الام (7 جرام/لتر) ويقل تركيزه اثناء فترة الرضاعة ليصل الى 1-2 جرام /لتر في لبن الام بينما يكون تركيزه في سرسوب والبان الابقار اقل بمقدار 10 مرات مما هو في سرسوب ولبن الام.
ويكون الوزن الجزيئي للاكتوفيرين في لبن الام 80 كيلو دالتون و يتكون من 703 حمض اميني بينما لاكتوفيرين لبن الابقار له وزن جزيئي 77 كيلو دالتون و يتكون من 689 حمض اميني.
واللاكتوفيرين عباره عن جليكوبروتين يتكون من سلسله مفرده من الببتيد العديد وتنقسم الى فصين: الفص الاميني والفص الكربوكسيلي و يتصل الفصان معا بواسطة منطقه حلزونية. ويحتوي كل فص على منطقة مخصصة لربط الحديد ومنطقة اخرى للارتباط بالشق الكربوهيدراتي.ويتشابة الفصان من حيث التكوين لكنهما يختلفان في درجة قابليتهما للارتباط بالحديد. ويتشابة لاكتوفيرين اللبن االبقري ولاكتوفيرين لبن الام من حيث التركيب ونسبة التشابه بينهما في ترتيب تتابعات الاحماض الامينية تصل الى 70 %.
ويعتبر الحديد المعدن الرئيسي الذي يربط او يخلب بواسطة اللاكتوفيرين ، لذا فان هناك 3 انواع من اللاكتوفيرين طبقا لدرجة تشبعه بالحديد: اللاكتوفيرين المشبع بالحديد (يرتبط بذرتين حديد و يسمى Holo-Lf or Fe-saturated Lf) واللاكتوفيرين غير المشبع بالحديد (لا يرتبط باي حديد و يسمى Apo-Lf or unsaturated Lf ) واللاكتوفيرين الذي يربط ذرة حديد واحدة ويسمى بال . monoferic Lf ويوضح شكل 1 تركيب اللاكتوفيرين.
وللاكتوفيرين قابلية عالية للارتباط بالحديد ومع ذلك فان الحديد يبدأ في التحرر او الانطلاق من لاكتوفيرين اللبن البقري على رقم pH يساوي 4 و يكون التحرر مكتملا على رقم pH يساوي 2 بينما يبدأ الحديد في التحرر من لاكتوفيرين لبن الام على رقمpH اقل من 3 ويكون التحرر كاملا عند رقم pH اقل من 1.5 . كما يعتبر اللاكتوفيرين بروتين ثابت ضد التحلل البروتيني سواء معمليا او داخل القناه الهضمية.
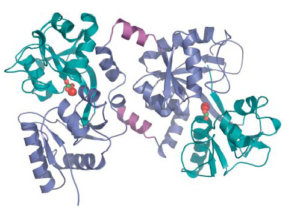
ثبات اللاكتوفيرين
تتأثر درجة ثبات اللاكتوفيرين بعدة عوامل مثل: درجة نضج الجهاز الهضمي والذي يحدده درجة نشاط الانزيمات الهاضمة و رقم pH المعدة، ، كما يتأثر ثباته بدرجة تشبعه بالحديد وتشبعه بالشق الكربوهيدراتي. ويكون اللاكتوفيرين ثابتا بدرجة عالية تحت ظروف القناة الهضمية للاطفال حيث يكون pH المعده مرتفع (4) ويكون تركيزونشاط انزيم الببسين اقل بينما يكون اللاكتوفيرين اقل ثباتا في القناه الهضمية للبالغين. ايضا يكون تكوين الببسين مختلف و يكون اقل نشاطا مؤديا الى زيادة ثبات اللاكتوفيرين تحت ظروف القناه الهضمية للاطفال. كما لوحظ ان هناك اختلاف في درجة ثبات اللاكتوفيرين بين التجارب المعمليه أو تلك التى تجرى باستخدام الكائنات الحية ويرجع ذلك الى وجود اختلاف بين النموذجين من حيث وجود الفوسفوليبيدات والميكروبات المعوية والتى تتواجد في نموذج الدراسات التي تجرى باستخدام الكائنات الحية بينما تغيب هذه المكونات في النموذج المعملي والتى يستخدم فيها خليط من الانزيمات التجارية البسيطة.
ويؤدي فقد الشق الكربوهيدراتي وتحلله في اللاكتوفيرين الى انخفاض درجة ثبات البروتين مما يؤدي الى تكوين بعض الببتيدات النشطة حيويا مثل اللاكتوفيريسين. كما تعتبر درجة تشبع البروتين بالحديد عاملا اخرا يؤثر في درجة ثباتة حيث لوحظ ان البروتين المشبع بالحديد اكثر ثباتا من غير المشبع بالحديد ويرجع ذلك الى ان اللاكتوفيرين المشبع بالحديد يكون في صورة جزيء مغلق بينما يكون اللاكتوفيرين غير المشبع بالحديد على هيئة جزيء مفتوح. وعلى الرغم من ان اللاكتوفيرين غير المتحلل مهم جدا فيما يتعلق بامتصاص الحديد حيث ان الصورة الكامله من البروتين intact protein تستطيع نقل الحديد الى داخل الخلايا الطلائيه المعويه ، الا ان الهدم الجزئي للاكتوفيرين يؤدي الى تكوين بعض الببتيدات النشطه بيولوجيا ويكون لها وظائف فسيولوجية متعددة وغالبا ما تكون هذه الببتيدات اكثر فاعلية من اللاكتوفيرين نفسه.
الببتيدات النشطه حيويا للاكتوفيرين
معظم البروتينات الغذائيه تحتوي على بعض التتابعات من الاحماض الامينية غير النشطة داخل البروتين الاصلي native or parent protein وعند تحررها من البروتين الاصلي عن طريق الهضم او التحلل يظهر نشاطها البيولوجي. ويحتوي اللاكتوفيرين في نهايتة او فصه الاميني على تتابع من الاحماض الامينيه يحمل شحنة موجبة يسمى باللاكتوفيريسين Lactoferricin domain. ويوجد تتابع اللاكتوفيريسين في لاكتوفيرين اللبن البقري في المنطقة بين 17-41 حمض اميني وهو بطول 25 حمض اميني و يحتوي على 5 احماض امينية ارجنين موجبة الشحنة بينما لاكتوفيريسين لبن الام يكون بطول 49 حمض اميني تقع في المنطقة بين 1-49 ويحتوي على 8 احماض امينية ارجنين و يسمى الجزء من الحمض 1 الى الحمض 11 باسم اللاكتوفيرامبين.
ويرتبط اللاكتوفيرين او الببتيدات موجبة الشحنة المشتقة منه بالليبوبولي سكاريد الذي يتميز باحتوائه على بعض مجموعات الفوسفات سالبة الشحنة.ويكون الاختلاف في تركيب وعدد الاحماض الامينية موجبة الشحنة وحجم الببتيد هو المسئول الرئيسي عن الفعل الوظيفي للببتيد والخاص بقدرته على العمل كمضاد للميكروبات او للالتهابات. ومن المفيد هنا ان نذكر ان الببتيدات المشتقة من اللاكتوفيرين لها قدرة اعلى على منع الالتهابات من البروتين نفسه و يرجع ذلك الى حجمها الصغير مما يسهل من دخولها الى الغشاء الخارجي للخلايا البكتيرية الممرضة ووصولها و تفاعلها مع مجموعات الفوسفات سالبة الشحنة لليبوبولي سكاريد.
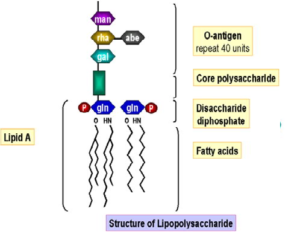
تركيب الليبوبولي سكاريد
الليبوبولي سكاريد هو مكون تركيبي في الغشاء الخارجي للجدار الخارجي للبكتريا السالبة لجرام وهو بولي انيونيك جليكوليبيد سالب الشحنة يتكون من 4 مناطق مرتبطة معا و هي 1- Lipid A, 2- Inner core, 3-Outer core, 4-Somatic O antigen. المنطقه الاولي هي ليبيد أ lipid A ، الذي يحتوي على 2 جزيء من الجلوكوز امين المفسفر والذي يرتبط مع 6 احماض دهنية طول سلسلتها الكربونية 12-14 ذرة كربون. المنطقة الثانية و هي ال inner core و الذي يرتبط بال lipid A ، يتكون من 2 او اكثر من وحدات 2-keto-3-deoxyoctonic acid المتصلة باثنين او ثلاث وحدات من ال heptoses و من المثير للدهشة ان مكونات هذه المنطقة تتواجد فقط في البكتريا. اما المنطقة الرابعة فتتكون من تتابعات انتيجينية عالية ومتكررة من عديد السكريات او البولي سكاريد المرتبطة بالسكريات الطرفية لل outer core .
من المعروف ان الLPS هو المكون الرئيس المسبب للسمية في الجدار الخلوي للبكتريا السالبة لجرام والذي يرتبط بمستقبلات خاصة على اسطح خلايا العائل و تعتبر خطوة الارتباط هذه اولى خطوات حدوث العدوى الميكروبية. ويوضح شكل 2 تركيب LPS
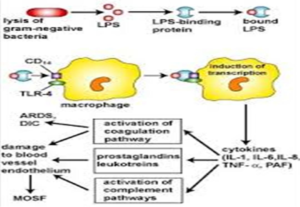
دور ال LPS في تحفيز الاستجابة المناعية
من الممكن ان تؤدي العدوى الميكروبية بواسطة ال E. coli الى حدوث حالة من الالتهابات المعوية المزمنة نتيجة قدرتها على تكوين LPS. وتحت هذه الظروف فان LPS يسبب الالتهاب المزمن من خلال قدرتة على تنشيط مدى واسع من الخلايا مثل neutrophils, mononuclear cells (monocytes, and macrophages) and microvascular endothelial .
وقد اكدت العديد من التجارب الاكلينيكية ان انتقال البكتريا الممرضة من القناة الهضمية الى اجزاء الجسم الاخرى مثل العقد الليمفاوية الوسطى ، الكبد، الطحال ومجرى الدم تؤدي الى تنبيه حدوث العدوى الميكروبية. وعند وصول الميكروبات الممرضة اوسمومها الى مجرى الدم يحدت اعلى تنشيط لخلايا ال leukocytes مؤديا الى حدوث استجابة مناعية مزمنة. وتحدث هذه الاستجابة المناعية نتيجة تكون العديد من المكونات المحفزة للالتهابات فى الامعاء مؤدية الى زيادة في نفاذية الاغشية الخلوية للخلايا المعوية و يصاحب ذلك زيادة انتقال السموم الميكروبية عبر الحواجز ما بين الخلايا والتى تسمى بال tight junction. وتتسبب هذه المكونات الذائبة في تكوين السيتوكين المنبهة للالتهابات مثل TNF-alpha, prostaglandin كما انها تؤدي الى خفض درجة حرارة الجسم ، تجلط الدم داخل الاوعية الدموية، فشل بعض اعضاء الجسم وصدمة التهابية واحيانا الوفاة.
وتتكون وتنشط معظم المواد المحفزه للالتهابات بعد ارتباط ال LPS مع مستقبلاتة وتكون احد الآليات هي تفاعل ال LPS مع المستقبل الذائب المسمى LPS binding protein (LBP) مكونا معقد يمكن التعرف علية بواسطة االلاقمات الخلوية phogocytes عبر مستقبلات بروتين الغشاء الخلوي mCD14 و التي تنقل ال LPS الى مستقبل بروتيني آخر هو MD2 . LPS-MD2 complexes كما يمكن ان تنشط وترتبط بمستقبل آخر هو TLR-4. وعلى الرغم من ان الخلايا المبطنة للاوعية الدموية endothelial cells لا يوجد على غشاءها الخلوي المستقبل mCD14 الا ان المستقبل sCD14 يمكنه ان يتفاعل مع ال LPS مكونا معقد يمكن ان يرتبط و ينشط المستقبل TLR-4 و الذي بدوره يؤدي الى تنشيط عامل النسخ الاعتيادي المسمى nuclear factor (NF)-kB و هو عباره عن بروتين ينظم النسخ و التعبير الجيني لبعض الجينات الخاصة بالمواد المحفزة للالتهابات مثل TNF and IL-8 genes. (شكل 3 يوضح دور LPS في تحفيز الاستجابة الالتهابية).
Lf as anti-inflammatory factor and Lf-LPS interaction
يعتبر النشاط المضاد للالتهابات الخاص باللاكتوفيرين واحد من اهم الادوار الوظيفيه المعروفه للاكتوفيرين على نطاق النظام المناعي سواء معمليا او داخل الكائنات الحية. كما ان للاكتوفيرين دورا هاما في تعديل الاستجابة المناعية سواء المناعة المكتسبة او الموروثة. ويقوم هذا البروتين بدعم تنشيط وتمييز خلايا النظام المناعي مؤديا الى ضبط الاستجابة المناعيه بما يعود بالنفع على الجسم و هذا التأثير ربما ينتج من الارتباط بين الاحماض الامينية موجبة الشحنة للاكتوفيرين ومجاميع الفوسفات سالبة الشحنة الموجودة على اسطح الخلايا المختلفة للنظام المناعي. كما ان له القدره على زيادة التعبير الجيني لانواع مختلفه من السيتوكين cytokines في الامعاء مثل IL-8, IFN-γ, IL-12, IL-7 .
المصدران الاساسيان للاكتوفيرين في اماكن الالتهابات هما
- اللاكتوفيرين المفرز بواسطة خلايا ال neutrophils ويسمى endogenous Lf
- اللاكتوفيرين الذي يصل الى الدم من مصدر غذائي ويسمى exogenous Lf
- ويكون للاكتوفيرين الموجود في الاغذية القدرة على الانتقال على صورة بروتين كامل intact protein من الامعاء الى مجرى الدم عبرمستقبلات خاصه على سطح الغشاء الخارجي للخلايا الطلائية المعوية بواسطة عملية الابتلاع او الالتقام الخلوي endocytosis .
- وينتقل خلال الثلاثة ايام الاول بعد الولاده 3 جرام من اللاكتوفيرين يوميا الى مجرى الدم حيث يمكن ان تصل الى اماكن الالتهابات البعيدة عن القناه الهضمية ولذلك يلاحظ ان العدوى الميكروبية والالتهابات المعويه تحدث بدرجة اقل في الاطفال حديثي الولاده الذين يتغذون على لبن الام كمصدر غذائي وحيد عنه في هؤلاء الاطفال الذين يعتمدون في التغذية على تركيبات البان الاطفال المصنعه.
وقد تم دراسة تأثير اللاكتوفيرين المعادل للنشاط المحفز للالتهابات لل LPS معمليا وفي الكائنات الحية ولوحظ ان اللاكتوفيرين يخفض من تركيز ال LPS في بلازما الدم. كما لوحظ ان حقن ال LPS في حيوانات التجارب يؤدي الى زيادة تكوين اكسيد النيتريك و nitric oxide and prostaglandin في حين ان المعاملة باللاكتوفيرين تقلل من انتاج هذه المكونات. كما وجد ان اللاكتوفيرين يخفض نشاط NO synthase and cyclooxygenase-2 مما يخفض من تكوين المكونين السابقين.
ويكون للاكتوفيرين القدره على الارتباط بال LPS و بالتالي يمنعه من الارتباط مع مستقبلاته على اسطح خلايا العائل. وله ايضا القدره على الارتباط بال LPS-receptors complexes خاصة LBP . وقد وجد ان التركيز العالي من اللاكتوفيرين يقلل من LPS الحر. و هكذا فان وجود اللاكتوفيرين يؤدي الى انخفاض الكميات المتكونه من المكونات المحفزه للالتهابات مثل nitric oxide, IL-8, ROS, TNF-α .
كما يعمل اللاكتوفيرين على خفض كمية ROS المتكونه مما يقلل من جهد الأكسدة. ووجد ان هذا البروتين يؤدي الى زيادة تكوين النوع المفيد من RO الذي له دور هام في قتل الميكروبات الممرضة عبر عملية الالتقام بينما يثبط تكوين النوع الضار من ROS الذي يسبب تلف الانسجة.
نوعي اللاكتوفيرين (الغذائي و المتكون بواسطة خلايا ال neutrophils) لهما القدرة على تثبيط قدرة LPS على دفع بعض الخلايا المناعية على تكوين ال superoxides . وله ايضا القدره على الارتباط بمستقبل اخر يوجد على اسطح خلايا ال neutrophils و المسمى L selectin وهو مستقبل له قابلية للارتباط بال LPS و هكذا فان البروتين او ببتيداتة الحيوية تمنع ارتباط هذا المستقبل مع LPS مؤديا الى خفض تكوين ال ROS. (ويوضح شكل 4 دور اللاكتوفيرين في تعطيل عمل ال LPS من خلال الارتباط به او بمستقبلاته ).
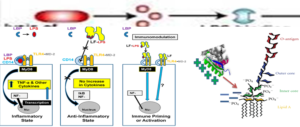
وفي النهاية يمكن القول ان اللاكتوفيرين عباره عن جليكوبروتين له وظائف فسيولوجية متعددة من بينها دوره في منع او تخفيف حدة الاستجابة المناعية الالتهابية عبر قدرته على الارتباط بال LPS او مستقبلاته مما يخفض من تكوين المواد المحفزة للالتهابات مثل nitric oxide, IL-8, ROS, TNF-α والتي تعمل على زيادة نفاذية الاغشية الخلوية وكسر الحواجز بين الخلايا وفقدها لوظيفتها.
دراسة الدور الوظيفي للاكتوفيرين من اعداد
د. عصمت علي السيد علي
باحث بقسم بحوث تكنولوجيا الالبان
أقرأ أيضا: د. شاكر عرفات يكتب عن يوم الغذاء العالمى …إنه يومك أنت













